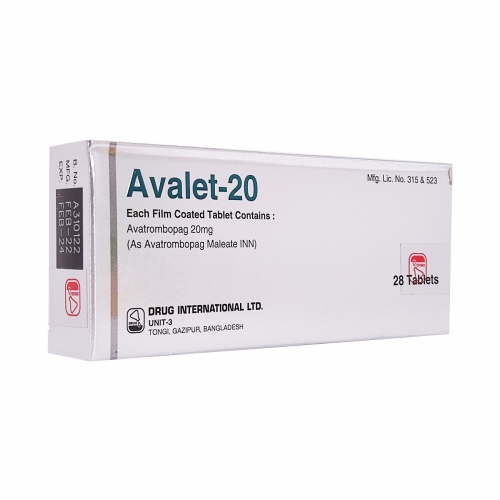
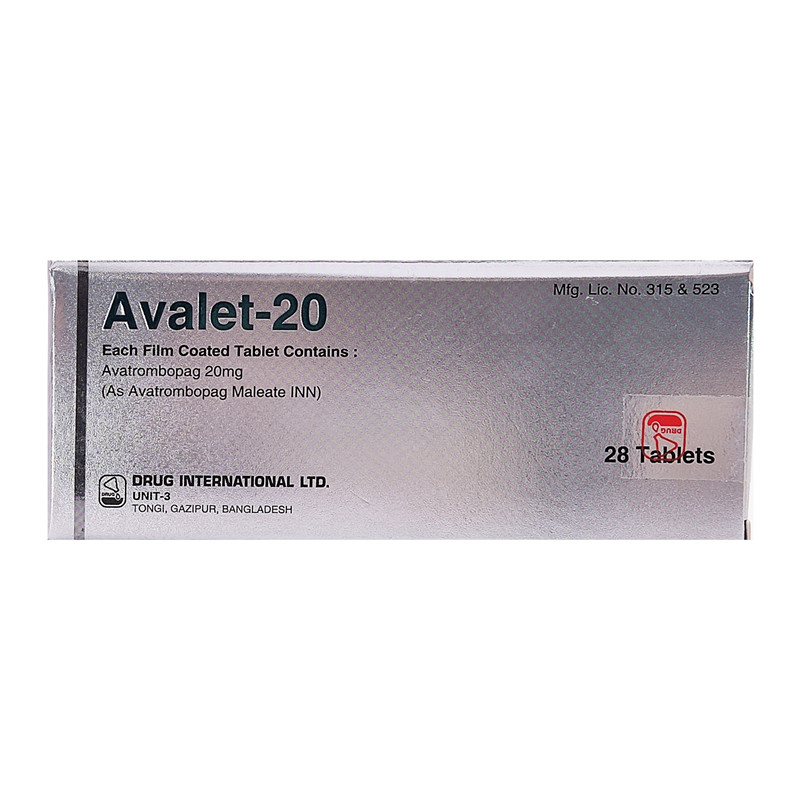
阿伐曲泊帕片
生产厂家:日本卫材
功能主治:TPO受体激动剂,治疗血小板减少症缓解率高
用法用量: 用法用量 1、慢性肝病患者的推荐剂量 在预定的手术前10至13天开始给药。 推荐的每日剂量是基于患者在计划的手术前的血小板计数(见下表)。 患者应在最后一剂阿伐曲泊帕片后的5-8天接受手术。 阿伐曲泊帕片应口服,每日1次,连续5天。 在错过剂量的情况下,患者应尽快服用下一剂剂量的阿伐曲泊帕片,并应在第二天的正常时间服用下一剂。 患者不应一次服用两剂,以弥补错过的剂量;所有5天的给药都应在规定时间内服用完成。 血小板计数(×109/L)每日一次持续时间 小于4060 mg (3片)5天 40~5040 mg (2片)5天 监测:在给阿伐曲泊帕片治疗前和手术当天测量血小板计数,以确保血小板计数充分增加。 2、慢性免疫性血小板减少症患者的推荐剂量 使用所需的最低剂量的阿伐曲泊帕片,以达到并维持血小板计数大于或等于 50×109 /L,减少出血的风险。 剂量的调整是基于血小板计数的反应。 不要用阿伐曲泊帕片来使血小板计数正常化。 初始剂量方案:开始用药,起始剂量为20 mg (1片),每日一次,与食物一起服用。 监测:在开始使用阿伐曲泊帕片治疗后,每周评估血小板计数,直到血小板计数大于或等于50×109/L达到稳定,此后每月获得血小板计数。 在停用阿伐曲泊帕片后至少4周内每周获取血小板。 剂量调整 血小板计数(×109/L)剂量调整 使用阿伐曲泊帕片至少2周后小于50按照下一个表格增加阿伐曲泊帕片的剂量 等待2周以评估该方案的效果和随后的剂量调整。 在200到400之间按照下一个表格减少阿伐曲泊帕片的剂量 等待2周以评估该方案的效果和随后的剂量调整。 大于400停用阿伐曲泊帕片 将血小板检测增加到每周两次 当血小板计数小于150×109/L时,按下一个表格降低剂量水平并重新开始治疗。 服用阿伐曲泊帕片 40mg,每日一次,4周后小于50停用药物 每周服用阿伐曲泊帕片20毫克2周后,大于400停用药物 慢性免疫血小板减少患者滴定剂量水平 使用剂量水平 每天40mg6 每周三次,每次40毫克,每周剩下的四天,每次20毫克5 每天20mg4 20mg,每周三次3 20mg,每周两次或40mg,每周一次2 20mg每周1 在错过剂量的情况下,患者应尽快服用下一剂剂量的阿伐曲泊帕片,并应在第二天的正常时间服用下一剂。 患者不应一次服用两剂,以弥补错过的剂量 停药:如果血小板计数在以最大剂量40mg每日一次用药4周后没有增加到大于或等于50×109/L,则停用阿伐曲泊帕片。 如果以每周一次20mg的剂量用药2周后,血小板计数大于400×109/L,则停用阿伐曲泊帕片。 慢性免疫性血小板减少症患者同时使用CYP2C9和CYP3A4的中度或强度双诱导剂或抑制剂的建议剂量 使用的药物推荐的剂量 CYP2C9和CYP3A4的中度或强度双重抑制剂一周三次,每次20毫克(1片) CYP2C9和CYP3A4的中度或强度双重诱导剂40毫克(2片),每日一次 不良反应 血栓性/血栓栓塞性并发症 在慢性肝病患者的临床试验中 最常见的不良反应(≥3%)为:发热、腹痛、疲劳、恶心、头痛、外周水肿。 最常见的严重不良反应为:低钠血症。 在慢性免疫性血小板减少症患者的临床试验中 最常见的不良反应(10%)为:头痛、疲劳、擦伤、鼻出血、上呼吸道感染、关节痛、牙龈出血、淤血、鼻咽炎。 最常见的严重不良反应为:头痛 ——以上数据均来自美国药监局官网阿伐曲泊帕片说明书不良反应板块
查看详情
阿伐曲泊帕(Avatrombopag)苏可欣国内上市了吗,阿伐曲泊帕(Avatrombopag)于2018年5月由美国食品药品监督管理局FDA批准上市,于2020年4月批准在国内上市。
近期,关于阿伐曲泊帕(Avatrombopag)苏可欣在国内的上市问题备受关注。阿伐曲泊帕是一种用于治疗血小板减少症的药物,其上市对于患有相关疾病的患者可能具有积极的意义。让我们一起来了解一下目前阿伐曲泊帕苏可欣在国内的最新动态。
1. 阿伐曲泊帕简介
阿伐曲泊帕是一种血小板生成素受体激动剂,主要用于治疗由于肝脏疾病导致的血小板减少症,如慢性肝病患者中的免疫性血小板减少症。它通过促进骨髓中的血小板生成,帮助提高患者的血小板水平,从而减轻相关症状和风险。
2. 阿伐曲泊帕在国内的审批过程
截至目前,阿伐曲泊帕苏可欣在国内的审批过程仍处于不确定的状态。药物的上市需要通过一系列的审批程序,包括临床试验、药物注册等步骤。一旦通过所有必要的程序,该药物方可在国内市场上市。
3. 阿伐曲泊帕的临床疗效与安全性评价
在进行药物上市前,通常需要对其临床疗效和安全性进行严格的评估。针对阿伐曲泊帕,临床试验的结果将直接关系到其是否能够获得批准上市。患者和医生们对于药物的有效性和安全性都有着极高的关注,这些数据将对决定药物上市的最终结论产生深远的影响。
4. 对患者的潜在意义
如果阿伐曲泊帕苏可欣成功在国内上市,将为患有免疫性血小板减少症的患者提供一种新的治疗选择。这对于改善患者的生活质量、减轻病痛和提高患者的整体健康状况都具有积极的作用。因此,药物上市对于相关患者和医疗社区来说都是一项可期待的好消息。
总的来说,阿伐曲泊帕苏可欣在国内上市的问题仍在观望之中。随着相关审批程序的进行,我们期待着更多的详细信息和确切答案。患者、医生和制药行业的关注点都聚焦在这一新药的动态上,期望其早日在国内市场上为需要的患者提供帮助。