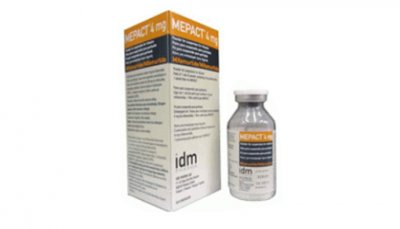
米伐木肽(mifamurtide)Mepact国内上市时间,米伐木肽(mifamurtide)在欧洲获得批准并上市的时间是在2009年3月,此外,2015年2月13日,米伐木肽在中国台湾上市。
1. 米伐木肽(Mepact):一种新的治疗非转移性骨肉瘤的希望
非转移性骨肉瘤是一种罕见但危险的骨肉瘤类型,通常出现在儿童和年轻人身上。长期以来,这种疾病的治疗一直是一个挑战。随着科学技术的不断进步,一种被称为米伐木肽(Mepact)的药物在治疗非转移性骨肉瘤方面带来了新的希望。
2. 米伐木肽(Mepact)在国内上市
经过严格的临床试验和监管程序,米伐木肽(Mepact)已经获准在国内上市。这意味着患有非转移性骨肉瘤的患者将可以更容易地获得这种创新药物的治疗。米伐木肽(Mepact)的上市将为骨肉瘤患者提供希望和新的治疗选择。
3. 米伐木肽(Mepact)的治疗效果
研究显示,米伐木肽(Mepact)在治疗非转移性骨肉瘤方面表现出显著的疗效。它可以帮助抑制肿瘤的进展,减少瘤体的体积,并提高患者的生存率。这使得米伐木肽(Mepact)成为非转移性骨肉瘤综合治疗中不可或缺的一部分。
4. 米伐木肽(Mepact)的价值和前景
米伐木肽(Mepact)的国内上市对非转移性骨肉瘤患者来说是一个重要的里程碑。它为这些患者带来了一种创新的治疗选择,具有改善疗效和生存率的潜力。随着米伐木肽(Mepact)的使用和进一步的研究,我们有望进一步了解该药物的作用机制,并不断优化治疗方案,为患者提供更好的治疗效果和生活质量。
米伐木肽(Mepact)作为一种新的治疗非转移性骨肉瘤的药物,国内上市为患者提供了一种希望和新的治疗选择。这种药物的疗效已经得到了研究的证实,并且在临床中展现出卓越的效果。米伐木肽(Mepact)的上市对改善非转移性骨肉瘤患者的生存率和生活质量具有重要意义,同时也为进一步的研究和改进治疗方案提供了基础。希望米伐木肽(Mepact)的上市能够给患者带来更多的好处,并促进骨肉瘤治疗领域的进一步发展。