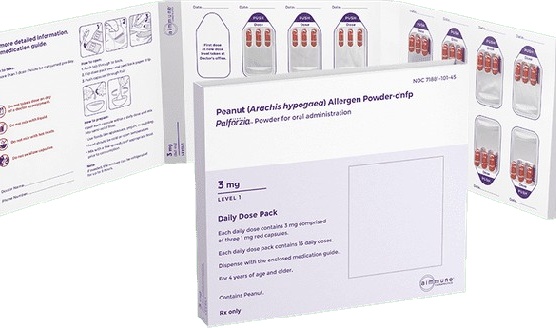
Palforzia(Peanut(Arachis hypogaea) Allergen Powder-dnfp)国内上市时间,Palforzia(Peanut(Arachis hypogaea) Allergen Powder-dnfp)于2020年1月31日获得美国FDA的批准上市,目前国内未上市。
Palforzia是一种用于治疗花生过敏症的新药,即将在国内市场上市。这种药物通过逐步暴露患者于微量花生蛋白中,帮助其逐渐建立免疫耐受,从而减少因花生过敏引起的严重反应风险。以下是关于Palforzia国内上市时间的详细介绍:
1. Palforzia的药理作用及临床应用
Palforzia是一种特异性免疫治疗药物,主要成分为花生过敏原粉末(dnfp),含有微量的花生蛋白。它的主要作用机制是通过逐步增加患者对花生过敏原的暴露量,从而促进免疫系统逐步建立对花生蛋白的耐受性。临床试验显示,Palforzia能显著降低花生过敏患者在接触花生后发生严重过敏反应的风险,改善患者的生活质量。
2. Palforzia在国外的临床应用及效果验证
在美国等国家,Palforzia已经被批准用于治疗5岁及以上的花生过敏患者。临床研究表明,经过适当的调整和监测,Palforzia可以安全地用于患者身上,并显著减少严重过敏反应的发生率。这为Palforzia在国内的推广和应用提供了坚实的临床基础和经验积累。
3. 国内上市时间及相关审批进展
目前,Palforzia在中国的药品注册申请已经进入了审批阶段。根据相关资料显示,预计Palforzia将在接下来的一两年内获得国内的上市批准,届时将为中国的花生过敏患者带来新的治疗选择。这也意味着在临床实践中,医生将能够为更多的患者提供个体化、有效的花生过敏治疗方案。
4. 对患者和医疗机构的影响及展望
Palforzia的国内上市将显著提升花生过敏患者的治疗水平和生活质量,减少其因意外接触花生引发严重过敏反应的风险。对于医疗机构而言,将需要建立相应的药物管理和监测体系,确保患者在使用Palforzia过程中的安全性和有效性。同时,随着Palforzia的推广,相关的过敏治疗技术和理念也将逐步在中国得到推广和普及。
在Palforzia即将在中国市场上市的背景下,花生过敏患者和医疗社区正期待这一新的治疗选择的到来,以帮助更多患者摆脱花生过敏的困扰,过上更加安全和健康的生活。