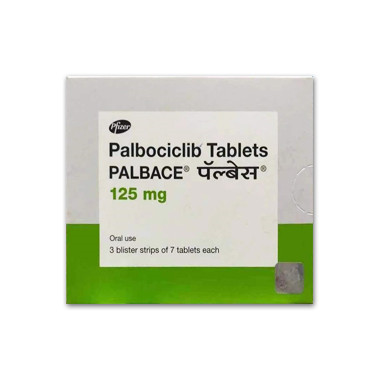
帕博西尼
生产厂家:孟加拉DIL耀品国际制药公司
功能主治:治疗晚期转移性乳腺癌,显著延长中位无进展生存期
用法用量:用法用量 Ibrance应由具抗癌药物使用经验的医生开始并监督本品治疗。 Ibrance的推荐剂量为125mg,每天一次,连续服用21天,之后停药7天(3/1给药方案),28天为一个治疗周期。 治疗应当持续进行,除非患者不再有临床获益或出现不可接受的毒性。 当与来曲唑联用时,来曲唑的推荐剂量为2.5mg,口服,每天一次,在整个28天治疗周期连续服药。 哌柏西利胶囊应整粒吞服(吞服前不得咀嚼、压碎或打开胶囊)。 如果胶囊出现破损、裂纹或其他不完整的情况,则不得服用。 应鼓励患者在每天大约相同的时间服药。 如果患者呕吐或者漏服,当天不得补服。 应照常进行下次服药。 在开始Ibrance治疗前、每个治疗周期开始时、前2个治疗周期的第15天以及有临床指征时应监测全血细胞计数。 对于前6个治疗周期内发生最高严重程度为1或2级中性粒细胞减少症的患者,其后续周期的全血细胞计数监测时间应为每3个月一次、各周期开始之前以及有临床指征时。 建议在中性粒细胞绝对计数(AbsoluteNeutrophilCount,ANC)≥1,000/mm3且血小板计数≥50,000/mm3时接受Ibrance。
查看详情
哌柏西利(Palbociclib)是一种治疗乳腺癌的药物,通过抑制细胞周期蛋白依赖性激酶(CDK4/6)来干扰癌细胞的增殖。它可以用于荷尔蒙受体阳性(HR+)和人类表皮生长因子受体2阴性(HER2-)的晚期或转移性乳腺癌的治疗。在国外,哌柏西利已经被批准上市,并被广泛用于乳腺癌患者的治疗。那么,哌柏西利在国内是否已经上市了呢?
目前,哌柏西利在国内尚未获得上市许可证。

然而,哌柏西利在国内的临床研究和申报工作已经取得了一定进展。根据中国食品药品监督管理局(CFDA)的相关要求,哌柏西利需要通过一系列的临床试验和审批程序,包括多中心临床研究、药物临床试验批准和新药上市申请等步骤才能够获得上市许可。
有关哌柏西利在中国的临床试验已经在若干癌症中心进行,以评估其对中国乳腺癌患者的疗效和安全性。这些试验包括不同治疗阶段的研究,如新辅助治疗、一线治疗、二线及以上治疗等。临床试验的结果将为哌柏西利在中国上市提供重要的科学依据。
对于乳腺癌患者和医生来说,哌柏西利的上市意味着将有更多的治疗选择,尤其是对于那些荷尔蒙受体阳性、HER2阴性的晚期或转移性乳腺癌患者。哌柏西利的使用可以有效地延长患者的无进展生存期,并提高治疗的整体效果。因此,乳腺癌患者和他们的家属对于哌柏西利的上市非常期待。
虽然
哌柏西利在国内尚未获得上市许可,但是中国正加快药物审批的进程,并努力缩短新药上市的时间。随着一系列的临床试验和评估工作的推进,相信不久的将来,哌柏西利将获得国内上市许可证,从而为乳腺癌患者带来更多的治疗机会。
总体而言,
哌柏西利作为一种治疗乳腺癌的药物,在国外已经取得了一定的治疗效果。虽然在国内尚未上市,但是临床试验和申报工作已经开始进行,预计不久的将来,乳腺癌患者将有机会获得这种新的治疗选择。同时,希望国内相关部门能够尽快审批并批准哌柏西利的上市,以满足患者的迫切需求。
 然而,哌柏西利在国内的临床研究和申报工作已经取得了一定进展。根据中国食品药品监督管理局(CFDA)的相关要求,哌柏西利需要通过一系列的临床试验和审批程序,包括多中心临床研究、药物临床试验批准和新药上市申请等步骤才能够获得上市许可。
然而,哌柏西利在国内的临床研究和申报工作已经取得了一定进展。根据中国食品药品监督管理局(CFDA)的相关要求,哌柏西利需要通过一系列的临床试验和审批程序,包括多中心临床研究、药物临床试验批准和新药上市申请等步骤才能够获得上市许可。