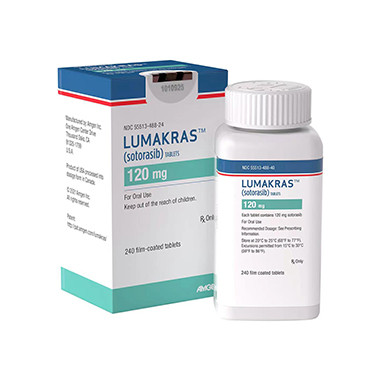
索托拉西布AMG510
生产厂家:老挝国立第二制药厂
功能主治:KRAS抑制剂,肺癌新特药
用法用量:用法用量 1.推荐剂量为960mg(8片),每天一次,直至疾病进展或出现不可接受的毒性。 如果漏服超过当日服药时间6小时以上,请跳过该剂量。 第二天服药仍按照原剂量服用,不要同时服用2剂来弥补错过的剂量。 吞下整粒药片,不要咀嚼、压碎或分裂药片。 2.建议的剂量减少 剂量降低剂量 首次剂量降低480mg(4片),每日一次 第二次剂量降低240mg(2片),每日一次 3.不良反应的推荐剂量调整 不良反应严重程度*本品剂量调整 肝毒性2级(谷丙转氨酶或者谷草转氨酶升高伴有症状) 暂停使用本品直至≤1级或基线水平; 恢复后,以下一个较低剂量水平恢复使用本品 3级(谷丙转氨酶或者谷草转氨酶升高) 谷丙转氨酶或者谷草转氨酶 > 3×ULN与总胆红素> 2 × ULN永久停用本品 间质性肺病(ILD)/肺炎任何级别 如果怀疑ILD/肺炎,暂停使用本品; 如果确诊ILD/肺炎,永久停用本品 恶心或呕吐3~4级 暂停使用本品直至≤1级或基线水平; 恢复后,以下一个较低剂量水平恢复使用本品 腹泻3~4级 暂停使用本品直至≤1级或基线水平; 恢复后,以下一个较低剂量水平恢复使用本品 其他不良反应3~4级 暂停使用本品直至≤1级或基线水平; 恢复后,以下一个较低剂量水平恢复使用本品
查看详情
索托拉西布药物由美国生物技术公司Amgen研发,它的研发历程经历了长达十多年的时间。早在2009年,Amgen科学家就开始针对KRAS突变的蛋白质结构展开研究,并且在2013年取得了突破性的进展。随着研究的深入,Amgen成功地发现了索托拉西布这个有望用于靶向治疗KRAS G12C突变癌症的候选药物。
与其他传统的靶向治疗药物不同,索托拉西布通过与KRAS突变蛋白质结合,并抑制其活性,阻断了致癌信号传导途径,从而抑制癌细胞的生长和扩散。这项革命性的研究成果给许多患有KRAS突变癌症的患者带来了福音。
根据报道,索托拉西布在临床试验中取得了显著的疗效。一项II期临床试验显示,KRAS G12C突变非小细胞肺癌患者接受索托拉西布治疗后,有高达50%的患者病情有所好转。此外,另一项I/IIa期临床试验结果显示,索托拉西布在其他类型的KRAS G12C突变癌症治疗中也表现出良好的疗效和耐受性。这些数据的积极性为索托拉西布的上市研究提供了有力的支持。
目前,索托拉西布在全球多个国家都已经获得了临床试验的批准。尽管早期试验结果非常鼓舞人心,但要让索托拉西布顺利上市在中国仍然需要经历一系列严格的审批程序。根据了解,索托拉西布的中国上市时间尚未确定。然而,据Amgen公司子公司百济神州公告称,索托拉西布的中国上市进展良好,预计将于2022年获得上市批准。
索托拉西布作为一种全新的抗癌药物,对于KRAS突变癌症患者来说是一种福音。相信随着索托拉西布的上市,将为更多患者提供新的治疗选择,改善其生存率和生活质量。此外,索托拉西布的研发也为中国生物医药行业注入了新的活力,推动了我国抗癌药物研究的发展。
总而言之,索托拉西布作为一种有望治疗KRAS突变癌症的创新药物,引起了全球医学界的广泛关注。尽管中国上市时间尚未确定,但我们有理由相信,索托拉西布的上市将为中国的癌症患者带来福音,同时也为我国生物医药行业的发展注入新的活力。我们期待着索托拉西布在不久的将来能够早日问世,造福更多的患者。
 根据报道,索托拉西布在临床试验中取得了显著的疗效。一项II期临床试验显示,KRAS G12C突变非小细胞肺癌患者接受索托拉西布治疗后,有高达50%的患者病情有所好转。此外,另一项I/IIa期临床试验结果显示,索托拉西布在其他类型的KRAS G12C突变癌症治疗中也表现出良好的疗效和耐受性。这些数据的积极性为索托拉西布的上市研究提供了有力的支持。
根据报道,索托拉西布在临床试验中取得了显著的疗效。一项II期临床试验显示,KRAS G12C突变非小细胞肺癌患者接受索托拉西布治疗后,有高达50%的患者病情有所好转。此外,另一项I/IIa期临床试验结果显示,索托拉西布在其他类型的KRAS G12C突变癌症治疗中也表现出良好的疗效和耐受性。这些数据的积极性为索托拉西布的上市研究提供了有力的支持。