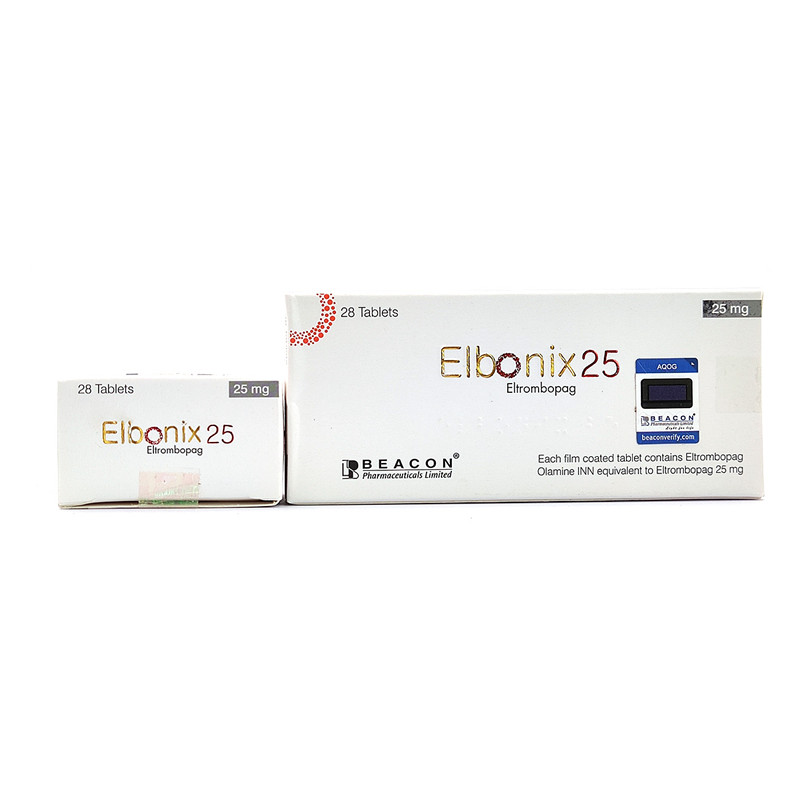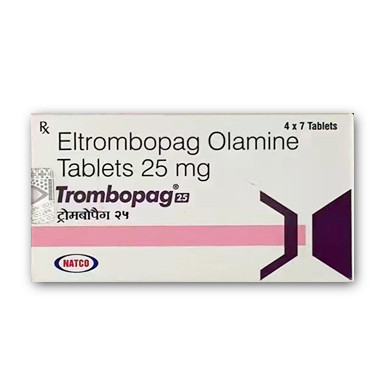
艾曲波帕
生产厂家:印度纳科Natco制药有限公司
功能主治:治疗慢性/持续性免疫性血小板减少症,临床缓解高
用法用量: 持续性或慢性免疫性血小板减少症 初始剂量方案 1、6岁及以上的ITP成人和儿童患者的艾曲波帕起始剂量为50 mg,每天一次。 但东亚/东南亚人种的患者或有轻度至重度肝功能损害(Child-Pugh A、B、C级)的患者除外。 2、对于东亚/东南亚人种的ITP患者,使用艾曲波帕的初始剂量减少为25 mg,每天一次。 3、对于ITP和轻度、中度或重度肝功能损害(Child-Pugh A级、B级、C级)的患者,使用艾曲波帕的初始剂量减少为25 mg,每天一次。 4、对于东亚/东南亚人种的伴有ITP和肝损伤的患者(Child-PughA、B、C类),初始剂量减少为12.5 mg,每日一次。 5、1-5岁ITP儿童患者:剂量25 mg,每日一次。 之后监测血小板计数,根据血小板计数调整剂量。 慢性丙型肝炎相关性血小板减少症 初始剂量方案 初始治疗时,剂量为25 mg,每日一次。 重度再生障碍型贫血 严重再生障碍性贫血患者一线治疗的初始剂量 年龄推荐剂量 12岁及以上年龄的患者150mg,每日一次,连续6个月 6到11岁的儿童患者75mg,每日一次,连续6个月 2到5岁的儿童患者2.5 mg/kg,每日一次,连续6个月 对于东亚/东南亚人种的严重再生障碍性贫血或轻度、中度或重度肝损伤患者(Child-PughA、B、C类),初始原剂量减少50%。 根据血小板计数来调整后续剂量。 难治性严重再生障碍型贫血患者的初始剂量 初始治疗时:剂量50 mg,每日一次。 对于东亚/东南亚人种的严重再生障碍性贫血患者或轻度、中度或重度肝损害患者(Child-PughA、B、C类),应减少剂量为25
mg,每日一次。 根据血小板计数来调整后续剂量。 服用说明 1、在不进餐或进食含钙量低(≤50毫克)的食物时服用艾曲波帕。 在服用其他药物(如抗酸剂)、富含钙的食物(含钙>50毫克,如乳制品、钙强化果汁、某些水果和蔬菜)或含有多价阳离子(如铁、钙、铝、镁、硒和锌)的补充剂之前至少2小时或之后4小时服用艾曲波帕。 2、不要分裂、咀嚼或压碎药片,不要与食物或液体混合。 3、只用水来准备悬浮液,注意:不可用热水来准备悬浮液。 不良反应 1、慢性丙型肝炎患者的肝功能失代偿 2、肝毒性 3、骨髓增生异常综合征死亡和进展为急性骨髓性白血病的风险增加 4、血栓性/血栓栓塞性并发症 5、白内障
查看详情
艾曲泊帕(瑞弗兰)国内有没有上市,艾曲泊帕(Eltrombopag)于2008年在美国上市。目前已经在中国上市,于2018年1月4日由国家药品监督管理局(NMPA)批准。
艾曲泊帕(Eltrombopag)是一种常用于治疗特发性血小板减少症(ITP)的药物。对于许多患有ITP的患者而言,艾曲泊帕都扮演着至关重要的角色。对于国内是否上市,这一问题的答案要依赖于多个因素。下面将就这一问题作出详细解答。
1. 国内与国际市场的情况
在国际市场上,艾曲泊帕已经是一个广泛使用的药物,被列入了世界卫生组织基本药物清单,并且在多个国家获得了批准上市。就国内而言,艾曲泊帕的上市情况还需具体考察。
2. 国内药品监管政策
国内对于药品的批准与上市受到严格的监管政策,药品在获得批准后需要通过一系列的审批流程才能最终在国内市场上市销售。因此,艾曲泊帕是否在国内上市,需要视其在中国国家药品监督管理局(NMPA)的审批情况而定。
3. 患者需求与临床应用
考虑到ITP患者对艾曲泊帕的需求,以及在临床实践中对其疗效的认可,国内是否上市将对患者产生实质性的影响。就潜在的医疗需求和治疗效果而言,艾曲泊帕在国内上市将对患者和医疗机构产生积极作用。
4. 不断变化的药品市场
药品市场一直在不断变化,在某些情况下,一种药物可能已经获准在国内上市,而在另一些情况下则可能正在等待审批。因此,艾曲泊帕是否在国内上市需要关注最新的监管信息和市场动态。
总结而言,艾曲泊帕在国内的上市情况需要具体参照最新的国家药品监督管理局的批准与审批情况。对于ITP患者来说,艾曲泊帕的上市在治疗上将产生积极影响。