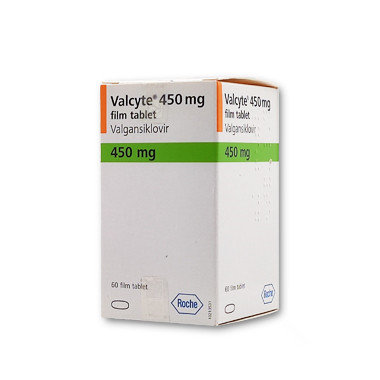
巨细胞病毒(Human Cytomegalovirus,简称CMV)感染是一种常见的病毒感染,尤其在获得性免疫缺陷综合征(Acquired Immunodeficiency Syndrome,AIDS)患者中表现更为严重。万赛维盐酸缬更昔洛韦片是一种广泛应用于治疗CMV感染的药物,在土耳其也得到了广泛的使用。
1. 万赛维盐酸缬更昔洛韦片的作用机制
万赛维盐酸缬更昔洛韦片是一种病毒抑制剂,通过阻断CMV DNA的合成来抑制病毒的复制和传播。缬更昔洛韦是一种静脉酯类似物,能够迅速被吸收和转化为活性形式。一旦进入细胞,通过细胞色素P450酶的作用,缬更昔洛韦被转化为活性代谢产物-冈西洛韦(Ganciclovir)。冈西洛韦以单磷酸鸟苷(GMP)的类似物形式,作为CMV DNA聚合酶的亲和剂,与病毒DNA链的延伸发生竞争性抑制,从而阻断了病毒复制过程。
2. 万赛维盐酸缬更昔洛韦片在AIDS患者中的应用
AIDS患者由于免疫系统受损,对于CMV感染的抵抗力明显降低。CMV感染可以引起多种严重的疾病,如视网膜炎、食管炎、肺炎等,严重影响患者的生活质量和预后。万赛维盐酸缬更昔洛韦片在AIDS患者治疗中起到重要的作用。该药物能够有效抑制CMV的复制,减轻病毒感染症状和相关并发症的发展,并提高患者的生存率。
3. 万赛维盐酸缬更昔洛韦片在土耳其的应用情况
土耳其是CMV感染的高发国家之一,因此万赛维盐酸缬更昔洛韦片在该国得到了广泛的应用。在土耳其的医疗机构中,万赛维盐酸缬更昔洛韦片被作为主要的治疗药物,用于感染CMV的AIDS患者。该药物在土耳其市场上也有多种品牌供应,让患者能够选择适合自己的用药方式。
4. 未来展望
随着医疗技术的不断发展,对于CMV感染的治疗也在不断改进。尽管万赛维盐酸缬更昔洛韦片在治疗CMV感染中已经取得了显著的成效,但仍然存在一些限制,如副作用和耐药性等问题。因此,科学家们正在不断寻求更加安全有效的药物,以提高CMV感染的治疗效果,并减少不良反应。
总结来说,万赛维盐酸缬更昔洛韦片是一种有效的治疗CMV感染的药物,在土耳其的应用得到了广泛推广。在AIDS患者中,该药物能够减轻CMV感染的症状,提高生存率。未来的研究将继续致力于探索更好的治疗方案,以进一步改善CMV感染患者的预后。