哌柏西利
生产厂家:老挝贝泉生物
功能主治:用于激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌
用法用量:【用法用量】应由具抗癌药物使用经验的医生开始并监督本品治疗。 哌柏西利的推荐剂量为125mg,每天1次,连续服用21天,之后停药7天(吃3周/停1周给药方案),28天为1个治疗周期。 治疗应当持续进行,除非患者不再有临床获益或出现不可接受的毒性。 当与来曲唑联用时,来曲唑的推荐剂量为2.5mg,口服,每天1次,在整个28天治疗周期连续服药。具体请参见来曲唑批准的说明书。 给药方法 口服。应与食物同服,最好随餐服药以确保哌柏西利暴露量一致。 哌柏西利不得与葡萄柚或葡萄柚汁同服。 哌柏西利胶囊应整粒吞服(吞服前不得咀嚼、压碎或打开胶囊) 如果胶囊出现破损、裂纹或其他不完整的情况,则不得服用。 应鼓励患者在每天大约相同的时间服药。 如果患者呕吐或者漏服,当天不得补服。应照常进行下次服药。 【剂量调整】 建议根据个体安全性和耐受性调整哌柏西利的剂量。 出现某些不良反应时可能需要暂时中断/延迟给药和/或减低剂量,或永久停药来进行控制,请参照表1、2和3中提供的方案进行剂量调整。 在开始哌柏西利治疗前、每个治疗周期开始时、前2个治疗周期的第15天以及有临床指征时应监测全血细胞计数。 对于前6个治疗周期内发生最高严重程度为1或2级中性粒细胞减少症的患者,其后续周期的全血细胞计数监测时间应为每3个月一次、各周期开始之前以及有临床指征时。 建议在中性粒细胞绝对计数(AbsoluteNeutrophilCount,ANC)≥1,000/mm3且血小板计数≥50,000/mm3时接受哌柏西利。 特殊人群 老年人 ≥65岁的患者无需调整哌柏西利的剂量。 儿科人群 尚未确定哌柏西利在≤18岁儿童和青少年患者中的安全性和疗效。没有数据可用。 肝损伤 轻度或中度肝损伤患者(Child-Pugh A级和B级)无需调整哌柏西利的剂量。 重度肝损伤(Child-PughC级)患者的推荐剂量为75mg,每天一次,采用3/1给药方案(见[注意事项]和[药代动力学])。 肾损伤 轻度、中度或重度肾损伤患者(肌酐清除率[CreatinineClearance,CrCl]≥15 mL/min)无需调整哌柏西利的剂量。 需要血液透析患者的数据不充分,无法对该人群提供任何剂量调整建议。 与CYP3A强效抑制剂合用时的剂量调整 避免伴随使用CYP3A强效抑制剂,考虑替换为没有或只有微弱CYP3A抑制作用的其他伴随用药。如果患者必须合用CYP3A强效抑制剂,则将哌柏西利的剂量减少至75mg,每天一次。如果停用强效抑制剂,则将哌柏西利的剂量增加至开始使用CYP3A强效抑制剂之前的剂量(在抑制剂的3至5个半衰期后)。
查看详情
首先,药物研发是一项复杂且昂贵的过程。
帕博西尼作为一种创新药物,其研发过程一般包括药物发现、临床前研究、临床试验等多个阶段。这些过程不仅需要资金的支持,还需要大量的人力、物力和时间投入。虽然中国在药物研发方面已经取得了一定的进展,但与国际上的先进水平相比,还存在一定的差距。因此,中国在帕博西尼的研发上可能面临诸多技术和经济上的限制。
其次,临床试验是药物研发的重要环节之一。帕博西尼能否在中国上市,需要通过临床试验来证明其疗效和安全性。临床试验需要进行多个阶段的测试和评估,包括动物实验、小规模试验和大规模试验等。在中国,临床试验的审批程序相对较为复杂,时间成本较高。并且,由于帕博西尼是一种新药物,其在人群中的安全性和疗效需要经过长期的观察和验证。因此,临床试验对于帕博西尼在中国市场上市而言可能存在较大的阻力。
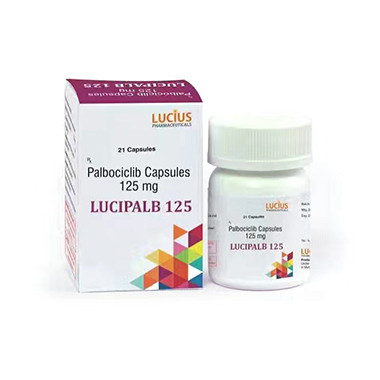
此外,药物上市的审批过程也是一个需要耗费时间和资源的过程。在中国,药物的上市审批需要经过多个部门的审核和评估,包括药监局、药检部门等。这些审批程序相对繁琐,时长也相对较长。因此,即使
帕博西尼成功通过了临床试验,也需要进行详细的数据整理和提交,以及长时间的等待审批过程。相比之下,其他国家的审批程序可能更为简化和高效。
最后,中国药物市场的特点也是导致帕博西尼没有出现在中国市场上的一个重要原因。在中国,药品价格受到较为严格的监管,并且药品的采购通常由政府或医院进行。由于帕博西尼价格较高,可能不符合中国市场的需求以及药品价格的限制。此外,中国国内早期乳腺癌患者的治疗方式和医疗体系相对较为传统,多为手术切除和放疗,对于药物治疗的需求并不明显。
综上所述,
帕博西尼在中国市场上没有出现的原因主要包括药物研发和临床试验的限制、审批过程的复杂性以及中国药物市场的特点。然而,随着中国医疗水平的提高和市场需求的变化,未来有望出现更多创新药物在中国市场上市。
 此外,药物上市的审批过程也是一个需要耗费时间和资源的过程。在中国,药物的上市审批需要经过多个部门的审核和评估,包括药监局、药检部门等。这些审批程序相对繁琐,时长也相对较长。因此,即使帕博西尼成功通过了临床试验,也需要进行详细的数据整理和提交,以及长时间的等待审批过程。相比之下,其他国家的审批程序可能更为简化和高效。
此外,药物上市的审批过程也是一个需要耗费时间和资源的过程。在中国,药物的上市审批需要经过多个部门的审核和评估,包括药监局、药检部门等。这些审批程序相对繁琐,时长也相对较长。因此,即使帕博西尼成功通过了临床试验,也需要进行详细的数据整理和提交,以及长时间的等待审批过程。相比之下,其他国家的审批程序可能更为简化和高效。